Defekte Mitochondrien stören Darm-Mikrobiom
Möglicher Auslöser von Morbus Crohn entdeckt
Chronischer Durchfall, Bauchschmerzen und Fieber sind typische Symptome von Morbus Crohn. Die Ursache dieser Krankheit ist bis heute nicht vollständig geklärt, jedoch ist seit einigen Jahren bekannt, dass sich das Darm-Mikrobiom, also die Zusammensetzung der Mikroben im Verdauungstrakt, bei Entzündungserkrankungen verändert. Einige Forschende sehen in dieser Veränderung, deren Ursachen bislang unbekannt waren, den Auslöser der Krankheit.
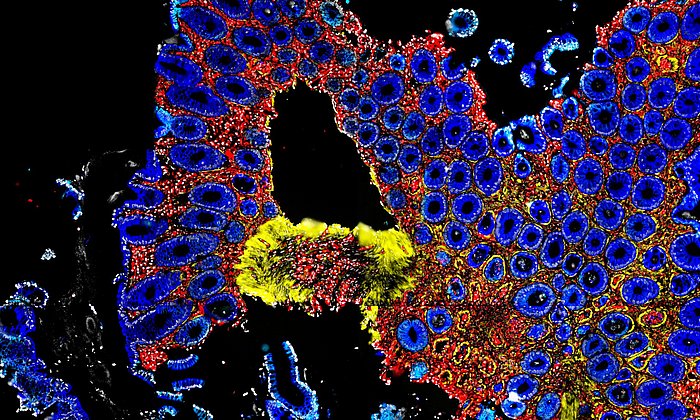
Ein Team um Dirk Haller, Professor für Ernährung und Immunologie und Direktor des Zentralinstituts für Ernährungs- und Lebensmittelforschung (ZIEL) der TUM, hat sich auf die Suche nach dem Grund für die Veränderungen des Mikrobioms gemacht und das Zusammenspiel von Mikrobiom, Darmepithel und Mitochondrien untersucht. Das Darmepithel ist die Zellschicht, die das Innere des Darms auskleidet, Nährstoffe aufnimmt und Krankheitserreger abwehrt. Mitochondrien sind kleine Strukturen in Zellen, die Nährstoffe in Energie umwandeln und damit den Stoffwechsel und die Funktionsfähigkeit von Zellen beeinflussen.
Mitochondrien-Störung führt zu verändertem Mikrobiom
Dirk Haller und sein Team verfolgen seit einigen Jahren die Hypothese, dass Mitochondrien nicht ausschließlich als Kraftwerke der Zellen dienen, sondern auch mit dem Mikrobiom interagieren. Zudem hatte vorangegangene Forschung gezeigt, dass das Darmepithel von Patientinnen und Patienten mit chronischen Darmentzündungen gewisse Stressmarker aufweist, die darauf hindeuten, dass die Mitochondrien nicht ordnungsgemäß arbeiten.
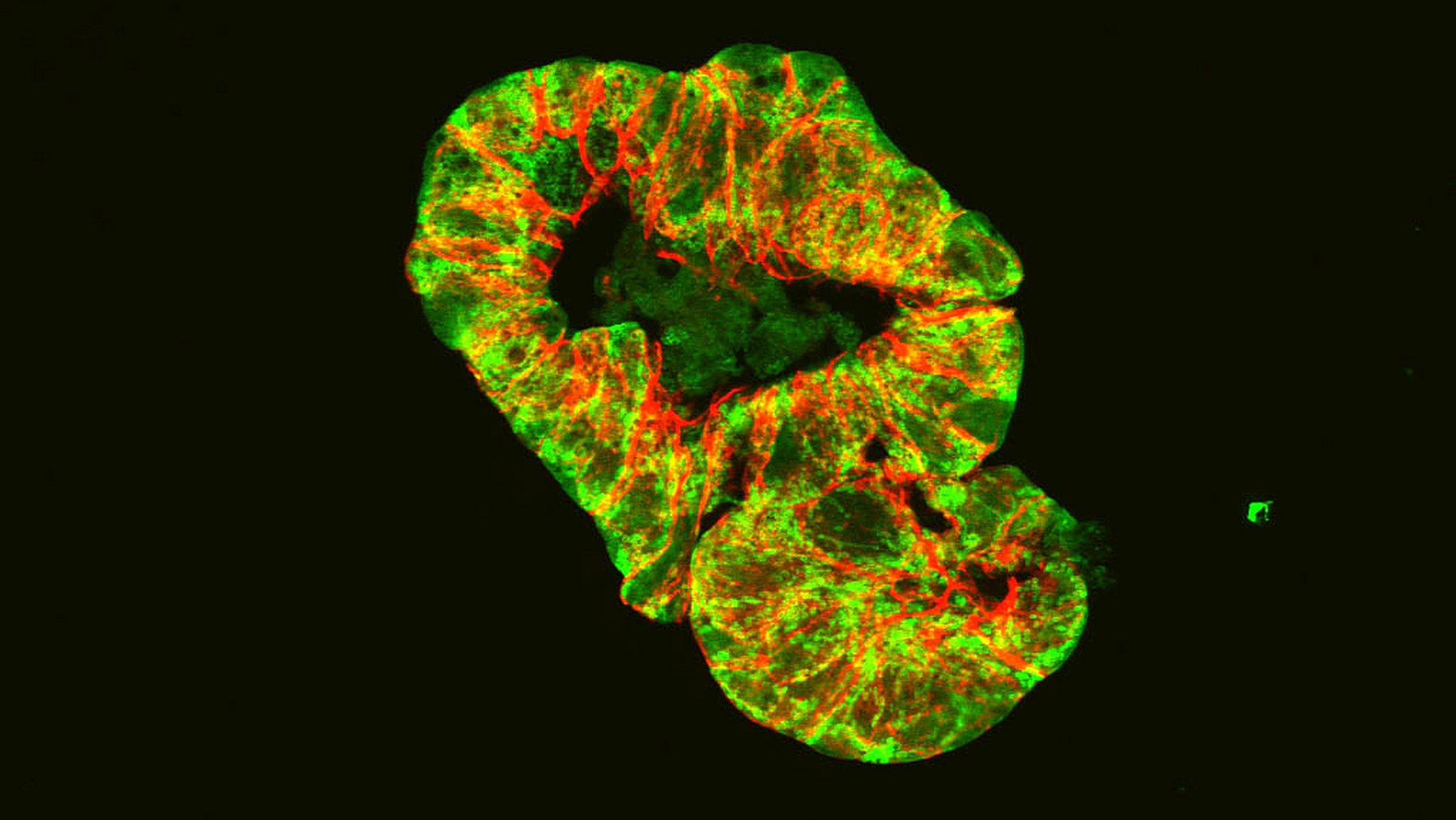
Für ihre Studie griffen die Forschenden deshalb in die Mitochondrien von Mäusen ein und entfernten einen Gen-Abschnitt, der für die Produktion des Proteins Hsp60 verantwortlich ist. Dieses Protein ist unerlässlich dafür, dass die Mitochondrien ihre Aufgaben erfüllen können. Der Eingriff stieß verschiedene Prozesse im Darm an. Zum einen ließen sich Gewebeschädigungen im Darmepithel nachweisen, die denen bei Morbus-Crohn-Patientinnen und -Patienten ähneln. Zudem zeigten sich Genaktivierungen, die für manche Stadien der Krankheit typisch sind. Außerdem – und für die Fragestellung des Teams wesentlich – reagierte das Mikrobiom auf die gestörten Mitochondrien, indem es seine Zusammensetzung änderte.
Damit konnten Dirk Haller und sein Team erstmals nachweisen, dass Störungen in den Mitochondrien ursächlich an Gewebeschäden im Darm beteiligt sind und darüber hinaus erkrankungsrelevante Änderungen im Mikrobiom auslösen.
Ausblick auf neue Medikamente
Für Betroffene könnte diese Erkenntnis wichtig werden, denn sie bietet Ansätze für neue Therapien. Aktuell lindert man mit entzündungshemmenden Medikamenten vor allem die Symptome von Morbus Crohn. „Die große Hoffnung ist, dass man Wirkstoffe findet, die die Funktionalität gestörter Mitochondrien wiederherstellen, sie also sozusagen reparieren, und so die Darmschädigung als Auslöser für chronische Entzündungsprozesse begrenzt,“ sagt Dirk Haller. „Unsere Ergebnisse legen nahe, dass Arzneien, die auf die mitochondrialen Stoffwechselwege einwirken oder die Verbindungen zwischen Mikrobiom und Mitochondrien angehen, ein Schlüsselelement zu einer besseren Behandlung sein könnten.“
Urbauer, E., Aguanno, D., Mindermann, N. et al.: Mitochondrial perturbation in the intestine causes microbiota-dependent injury and gene signatures discriminative of inflammatory disease. Cell Host & Microbe (2024), Volume 32, Issue 8. DOI: 10.1016/j.chom.2024.06.013
- Die Studie wurde im Sonderforschungsbereich „Microbiome Signatures“ (SFB 1371) durchgeführt.
- Für seine Forschung erhielt Dirk Haller 2021 den renommierten Forschungspreis der Europäischen Gesellschaft für Gastroenterologie (UEG).
Kontakte zum Artikel:
Prof. Dr. Dirk Haller
Technische Universität München
Lehrstuhl für Ernährung und Immunologie
Tel.: +49 8161-71 2026
dirk.haller@tum.de